京大ら、神経細胞が自ら樹状突起の形と向きを決めていくメカニズムを解明 [2012/06/13]
科学技術振興機構(JST)と京都大学は6月13日、マウスの大脳皮質において、神経細胞が自身の周辺の「道しるべ」を感知して自らの樹状突起の形と向きを決定していくメカニズムを解明したと発表した。
成果は、京大 大学院生命科学研究科の生沼泉助教と田坂元一大学院生らの研究グループと、同大学院生命科学研究科の根岸学教授の協力によるもの。JST課題達成型基礎研究の一環として行われた。研究の詳細な内容は、米国東部時間6月12日付けで米神経科学学会雑誌「The Jounal of Neuroscience」に掲載された。
学習や記憶といった高次脳機能を可能としているのは、神経細胞が神経突起を伸長し、お互いにシナプスを築くことによって形成される複雑な神経回路があるからだ。
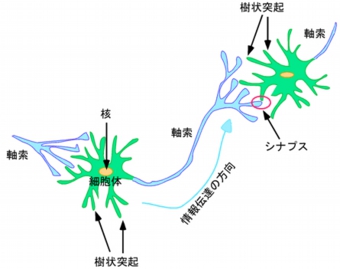
これまでの解剖学的な研究により、多くの神経回路のパターンがわかってきた。しかし、それらの形成機構に関する分子レベルの研究は近年、始まったばかりだ。脳神経系の構成単位である神経細胞は特異的な極性を持ち、通常は1本の長い「軸索」と複数の複雑に分枝した「樹状突起」を細胞体から伸展している(画像1)。
神経細胞間の情報伝達は軸索と樹状突起で構築される「シナプス」を介して行われる仕組みだ。樹状突起や細胞体で受け取った情報は、細胞体に集約され、軸索を通って隣の神経細胞の樹状突起や細胞体へ神経伝達物質が放出されることによって伝わる。
複雑で正確な神経回路網を形成するために、神経細胞はさまざまな制御を受けており、その中の1つが「軸索ガイダンス因子」による誘導作用だ。これまでに、神経軸索はさまざまな軸索ガイダンス因子に導かれて伸長し、目的のターゲット細胞へと投射しシナプス形成をすることがわかってきた。
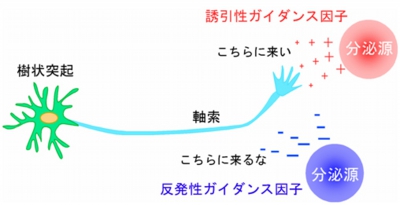
軸索ガイダンス因子は、誘引作用(こちらに伸長して来い)を示す「誘引性ガイダンス因子」と、反発作用(こちらに伸長して来るな)を示す「反発性ガイダンス因子」とに大きく分けられ、誘引作用を示すガイダンス因子の方向に神経軸索は伸長していき、反発作用を示すガイダンス因子があると、軸索がそれを遠ざけるようにして伸長することがわかっている(画像2)。
これまで、軸索ガイダンス因子の軸索に対する作用メカニズムはとてもよく研究されており、軸索内の細胞膜供給や細胞骨格(画像3)を変化させることによって、形や向きの変化を引き起こすことがわかっていた。
一方、的確な回路網形成には軸索と樹状突起の双方の制御が必要だ。しかし、神経細胞がその周辺の因子を感知して自らの樹状突起の形や向きの変化を引き起こすメカニズムは明らかではなく、樹状突起の細胞骨格系の制御メカニズム自体も謎だったのである。
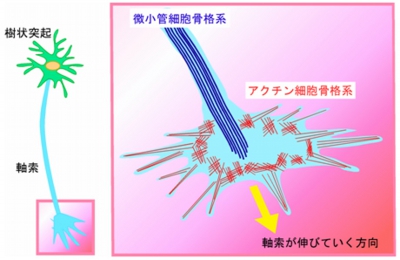
画像3。軸索の細胞骨格系。軸索は、微小管細胞骨格系やアクチン細胞骨格系によって形作られている
生沼助教らはこれまでに、ラットやマウスの脳から取り出して培養した神経細胞(初代培養神経細胞)や、マウス胎仔の生体の脳内への簡便な遺伝子導入法などを用いることにより、反発性ガイダンス因子「セマフォリン」が神経細胞に対して反発作用を示すメカニズムに関して明らかにしてきた。
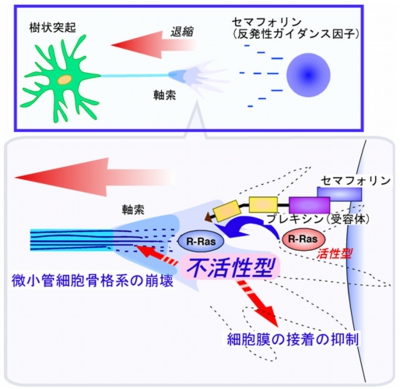
例えば、軸索にセマフォリンの刺激が入ると、受容体の「プレキシン」を介して「Rasファミリー低分子量Gタンパク質」である「R-Ras(アール・ラス)」を抑制し、軸索の伸長を阻害していることを明らかにしたのである(画像4)。
画像4は、セマフォリンによる軸索の退縮の作用機序を表した模式図だ。軸索において、セマフォリンは軸索に発現している受容体のプレキシンを活性化。これにより微小管細胞骨格系が崩壊し、細胞膜接着が抑制され、軸索の退縮が起こるという仕組みだ。
今回の研究では、これまで軸索での研究が進んでいた軸索ガイダンス因子、セマフォリン及びその受容体プレキシンが、樹状突起の向きや形を変化させる「樹状突起ガイダンス」における作用を検討し、そのメカニズムを世界で初めて明らかにした。
ラット胎児の大脳皮質から未熟な神経細胞を取り出して培養皿の上で培養すると、培養後5日目には複雑に枝分かれされた、樹状突起が形成される。その細胞に、セマフォリン刺激を90分間与えると、従来多くの研究者によって観察されていた軸索の退縮だけでなく、樹状突起の枝の部分も退縮して短くなっているのが確認された。
そこで、この退縮反応には樹状突起内の何らかの細胞骨格系の変化を伴うと考察。細胞骨格系の1つである「アクチン骨格」を蛍光染色して共焦点レーザ顕微鏡で観察したところ、セマフォリンの刺激によってアクチン骨格が樹状突起の先から消えてなくなっていることが確認されたのである(画像5)。
さらに、これらの樹状突起の枝の退縮やアクチン骨格の消失は、Rasファミリー低分子量Gタンパク質である「M-Ras(エム・ラス)」を常に活性化した神経細胞では、阻止できた(画像5)。
つまり、セマフォリンの刺激によりプレキシンがM-Rasの活性を抑制することで、樹状突起のアクチン骨格が消えることを示しており、軸索の場合のR-Rasを抑制した阻害とは、別のメカニズムであることが判明したというわけだ。
その画像5は、セマフォリン刺激による樹状突起先端のアクチン骨格の消失を共焦点レーザ顕微鏡で観察した写真だ。その内訳だが、上の12点の写真は、「M-Rasの恒常的活性型を遺伝子導入していない神経細胞」である。
そして左の列の画像はすべて樹状突起の形を、中央の列はアクチン細胞骨格を、右の列はその2つを重ね合わせた画像だ。なお、左列、中列の画像は見やすさのため白黒加工してある。また、神経細胞の形を確認するために同時にGFP遺伝子を導入して検出された。
そして、上の12点の内の上側の6点は、セマフォリン刺激を与えていないもの。上の3列は全体像で、その下の3列は先端部を拡大したものだ(そのほかも同様)。
上の12点の内の下側の6点は、セマフォリン刺激を与えた場合の画像。樹状突起の先端にアクチンが見られず、樹状突起の枝自体の長さも縮んでいる。
下の6点は、「M-Rasの恒常的活性型を遺伝子導入した神経細胞」で、セマフォリン刺激が与えられている。それにもかかわらず、樹状突起の枝は短くならないし、先端からアクチンがなくなっていない。
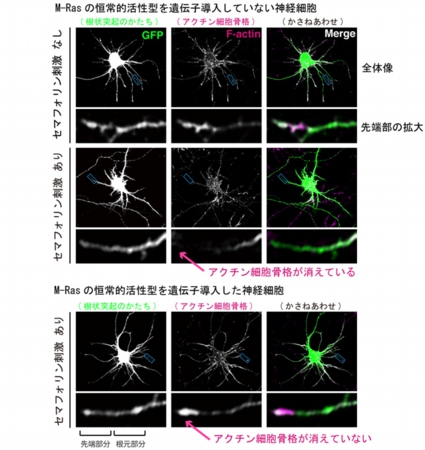
画像5。セマフォリン刺激による樹状突起先端のアクチン骨格の消失を様子を撮影したもの
では、プレキシンによってM-Rasの活性が抑制されるとなぜ、樹状突起内のアクチン骨格の崩壊が引き起こされるのだろうか。生沼助教らは、生化学的な結合実験や細胞染色によって、M-Rasが、アクチン骨格の安定化に関わっているタンパク質「ラメリポディン(Lamellipodin:Lpd)」に結合し、それを樹状突起の先端の細胞膜へ運ぶことを明らかにした(画像6)。
画像6は、ラメリポディンはM-Rasと結合し、樹状突起先端の膜に運ばれる様子を撮影したものだ。上段の写真3点は、左からアクチン細胞骨格、ラメリポディン、その2点を重ね合わせた画像。樹状突起の先端部分にラメリポディンが集積しているのがわかる。
下段左は神経細胞を可溶化し結合実験を行った結果で、ラメリポディンとM-Rasは神経細胞内で結合しているのが判明。下段右は細胞膜の分画実験を行った結果で、活性型M-Rasを遺伝子導入すると、ラメリポディンが細胞膜へ運ばれるのが確認された。
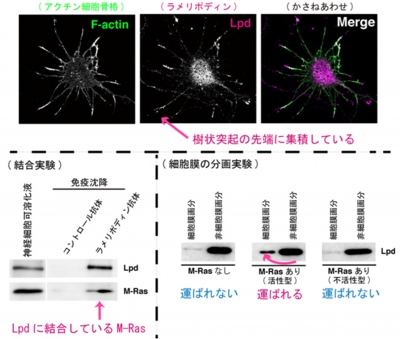
画像6。ラメリポディンはM-Rasと結合し、樹状突起先端の膜に運ばれる様子を撮影したもの
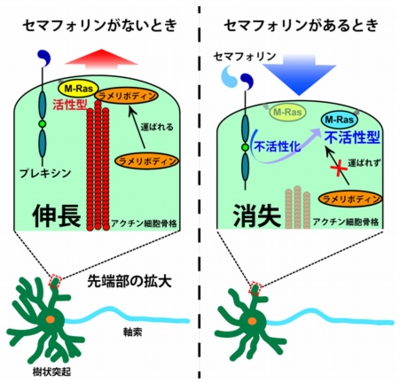
セマフォリンがない状態ではM-Rasが運ぶラメリポディンによって、樹状突起先端のアクチン骨格系の伸長が促される。一方、セマフォリンが存在すると、受容体のプレキシンによってM-Rasが不活性化され、ラメリポディンが樹状突起の先端へ運ばれなくなり、アクチン骨格系の伸長が抑制されるということがわかった(画像7)。
画像7は、セマフォリンによる樹状突起の退縮のメカニズムを表した模式図だ。左は、セマフォリンがない時にはプレキシンは活性化されていないため、樹状突起内部のM-Rasの活性は高く、アクチン細胞骨格の伸長に促進的に関わる分子であるラメリポディンは、樹状突起の先端部に運ばれ、結果としてアクチン細胞骨格の伸長が可能となる。
右はセマフォリン刺激がある時で、それによってプレキシンが活性化され、樹状突起内のM-Rasが不活性化されるため、ラメリポディンは樹状突起の先端部に運ばれない。結果としてアクチン細胞骨格の消失が起こり、樹状突起が退縮するというわけだ。
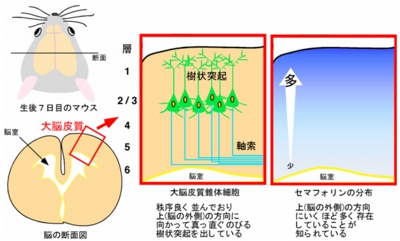
培養皿の上で培養した大脳皮質由来神経細胞に対しては、上記のようなメカニズムが明らかになったので、続いて実際の脳内での検討がなされた。大脳皮質内に存在する神経細胞である「錐体細胞」は、脳内では樹状突起を脳の外側(上方向)に向かってあまり枝分かれさせることなく、整然と伸ばしている。また、セマフォリンはこれまでの報告により、大脳皮質において外側ほど多く存在していることがわかっていた(画像8)。
画像8は、哺乳類(生後7日目のマウスの大脳皮質の断面)の大脳皮質の模式図。錐体細胞が秩序よく並んでいる。また、セマフォリンの分布が大脳皮質内で勾配があることは確認済み。
このことから、セマフォリンが大脳皮質の外側の部分で、樹状突起の枝分かれを抑制していると予想された。そこで、プレキシンの細胞内領域に直接結合してプレキシンの活性をブロックすることができる分子を作って、マウスの大脳皮質に遺伝子導入してみることに。すると、樹状突起の枝の本数の著しい増加と向きの乱れが観察されたのである(画像9)。
画像9は、プレキシンの活性阻害分子のマウス生体内への遺伝子導入の結果を捉えた写真。左は通常のもので、大脳皮質において、錐体細胞は内側から外側に向けて秩序よく並んでいる。右がプレキシンの活性阻害分子をマウス生体の大脳皮質に遺伝子導入したもの。樹状突起の枝の本数の著しい増加と、向きの乱れが引き起こされた。M-Rasやラメリポディンの活性型の導入でも、同様の効果が観察されている。
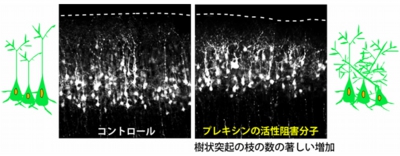
画像9。プレキシンの活性阻害分子のマウス生体内への遺伝子導入
また、同様の形と向きの変化は、M-Rasの活性型を遺伝子導入したり、ラメリポディンの活性型を遺伝子導入したりすることによっても観察された。これらの結果から、セマフォリン-プレキシンのシグナルは、実際のマウスの脳内においても、M-Rasやラメリポディンの活性を抑制することによって、樹状突起の形や向きを制御する「樹状突起ガイダンス因子」として働いていることが明らかになった。
軸索ガイダンス因子セマフォリンが、アクチン骨格系の制御を介して「樹状突起ガイダンス因子」としても働くというメカニズムは、これまでまったく知られていなかった世界初のメカニズムだ。
今回の樹状突起に関する成果及び、従来からの研究で明らかになっている軸索に関する知見を併せれば、セマフォリンはその受容体であるプレキシンを介して、神経細胞の軸索及び樹状突起の双方の伸長に対して阻害的に働くということになる。
セマフォリン及びその受容体プレキシンは線虫からヒトまで、種を超えて存在している重要な分子で、これまでの知見により、それらは神経損傷時の神経突起の枝分かれや伸長といった神経再生に阻害的に働くことも確認済みだ。また、セマフォリン及びその受容体プレキシンは脳以外にも、幅広い組織にあって、血管の枝分かれの形成においても阻害的に働くことが知られている。
今回の研究グループが作出したプレキシンの細胞内領域に直接結合してプレキシンの活性を生体内でブロックすることができる分子は、損傷神経細胞の神経突起や血管の再生誘導への応用が可能であると考えられることから、今回の研究成果は、神経科学分野のみならず、広範囲の生命科学分野や医学生物学分野にも貢献するものと期待されると、研究グループはコメントしている。